Exercice : Identification de polymorphes par ACD : Cas du F2692
Cet exercice a été conçu à partir d'une publication traitant du polymorphisme du F2692 (voir formule ci-dessous), parue dans le Journal of Pharmaceutical Science de 1992 ( Chauvet et col., 1992[1]).
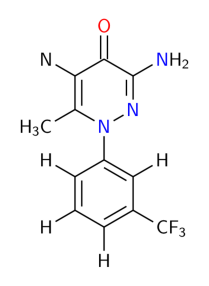
Deux formes cristallines 1 et 2 avaient été identifiées en tant que polymorphes vrais (ni solvatation, ni hydratation).
Les thermogrammes de la forme 2, obtenues suivant quatre vitesses de remontée en température (a), (b), (c) et (d) sont fournis. Si on ne considère que la trace (a) enregistrée à une vitesse de 1 °C.min-1, on voit à T=156 °C un petit événement endothermique, suivi d'un important événement endothermique à 180 °C. Un examen mené en parallèle sur la forme 2 par microscopie optique sous lumière polarisée et muni d'une platine chauffante montre que l'événement à 156 °C se traduit par une modification de la réfringence sans apparition de gouttelettes de liquide, alors qu'à 180 °C on assiste à la fusion de l'échantillon.
Question
Comment interprétez-vous ces résultats ? Quelle suggestion peut être faite à ce stade concernant le caractère monotrope ou énantiotrope du système 1-2 ?
Question
Afin de confirmer leur hypothèse, les chercheurs ont enregistré le thermogramme ACD[5] de la forme 2 à très haute vitesse (20 °C.min-1), qui ne montre plus qu'un pic de fusion situé à 171,8 °C. Sur le tableau sont récapitulées les températures et les enthalpies de fusion pour les deux formes obtenues dans les mêmes conditions de vitesse de chauffe.
Forme | \(T_f\) (°C) | \(\Delta H _f\) (kJ.mol-1) |
|---|---|---|
1 | 171,8 | 29,3 |
2 | 179,9 | 27,2 |
Cela vous aide-t-il à confirmer ou non votre conclusion précédente ?
Les chercheurs ont enfin effectué des mesures de solubilité thermodynamique dans l'eau des deux formes en fonction de la température. Les résultats obtenus sont présentés ci-dessous (représentation de Van't Hoff en \(\frac{1}{T}\), \(T\) étant la température absolue) :
Question
Sachant qu'il y a un point de croisement des courbes à \(\frac{1}{T} = 28,3.10^{-4} \textrm{ K}^{-1}\) :
Calculer la température absolue correspondant à ce point de croisement ;
Quelle interprétation faites-vous de cette expérience ? Est-ce cohérent par rapport à vos réponses aux questions 1 et 2 ?